活体动物体内光学成像(Opticalin vivo Imaging)主要采用生物发光(bioluminescence)与荧光(fluorescence)两种技术。生物发光是用萤光素酶(Luciferase)基因标记细胞或 DNA,而荧光技术则采用荧光报告基团进行标记。利用一套非常灵敏的光学检测仪器,让研究人员能够直接监控活体生物体内的细胞活动和基因行为。通过这个系统,可以观测活体动物体内肿瘤的生长及转移、感染性疾病发展过程、特定基因的表达等生物学过程。传统的动物实验方法需要在不同的时间点宰杀实验动物以获得数据, 得到多个时间点的实验结果。
相比之下,可见光体内成像通过对同一组实验对象在不同时间点进行记录,跟踪同一观察目标(标记细胞及基因)的移动及变化,所得的数据更加真实可信。另外, 这一技术对肿瘤微小转移灶的检测灵敏度极高,不涉及放射性物质和方法, 非常安全。因其操作极其简单、所得结果直观、灵敏度高等特点,在刚刚发展起来的几年时间内,已广泛应用于生命科学、医学研究及药物开发等方面。
-
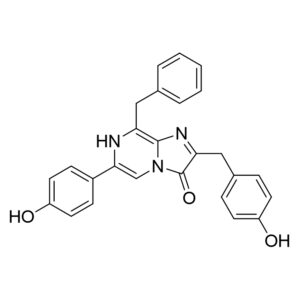 天然腔肠素;钙离子荧光探针腔肠素¥300.00 – ¥900.00
天然腔肠素;钙离子荧光探针腔肠素¥300.00 – ¥900.00 -
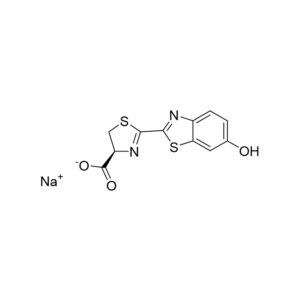 D-虫荧光素钠盐;D-荧光素钠盐¥600.00 – ¥10,000.00
D-虫荧光素钠盐;D-荧光素钠盐¥600.00 – ¥10,000.00 -
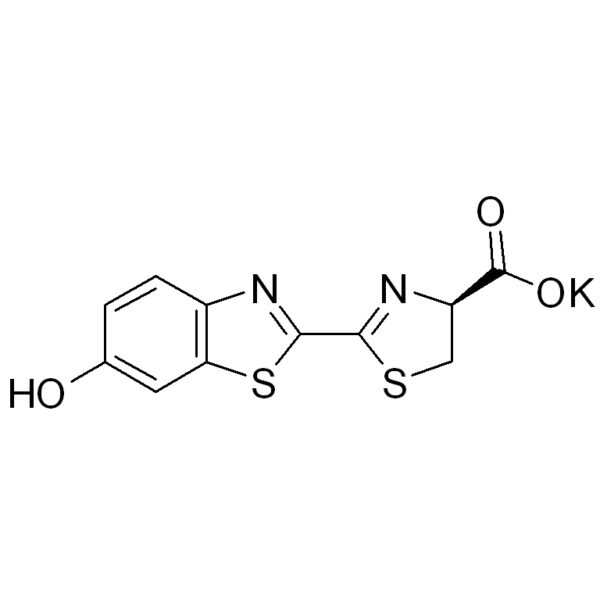 D-荧光素钾盐,D-虫荧光素钾盐¥200.00 – ¥10,000.00
D-荧光素钾盐,D-虫荧光素钾盐¥200.00 – ¥10,000.00 -
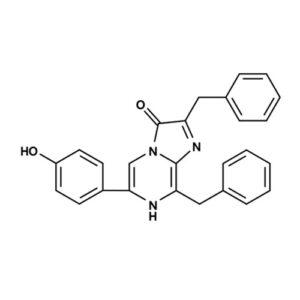 腔肠素-H;钙离子荧光探针腔肠素 h¥230.00 – ¥3,600.00
腔肠素-H;钙离子荧光探针腔肠素 h¥230.00 – ¥3,600.00 -
 D-荧光素,虫荧光素¥320.00
D-荧光素,虫荧光素¥320.00
应用交流:
一. 活体成像包括生物发光和荧光发光两种
1. 生物发光
通过分子生物学克隆技术, 应用单克隆细胞技术的筛选,将萤光素酶的基因稳定整合到预期观察的细胞的染色体内,培养出能稳定表达萤光素酶蛋白的细胞株。
典型的成像过程是:小鼠经过麻醉系统被麻醉后放入成像暗箱平台,软件控制平台的升降到一个合适的视野,自动开启照明灯拍摄第一次背景图。下一步,自动关闭照明灯, 在没有外界光源的条件下拍摄由小鼠体内发出的光,即为生物发光成像。
与第一次的背景图叠加后可以清楚的显示动物体内光源的位置,完成成像操作。之后,软件完成图像分析过程。使用者可以方便的选取感兴趣的区域进行测量和数据处理及保存工作。当选定需要测量的区域后,软件可以计算出此区域发出的光子数,获得实验数据。软件的数据处理和保存功能非常强大,可以加快实验速度,方便大批量的实验。
2. 荧光发光
荧光发光是通过激发光激发荧光基团到达高能量状态,而后产生发射光。常用的有绿色荧光蛋白(GFP)、红色荧光蛋白 DsRed 及其它荧光报告基团,标记方法与体外荧光成像相似。荧光成像具有费用低廉和操作简单等优点。同生物发光在动物体内的穿透性相似,红光的穿透性在体内比蓝绿光的穿透性要好得多,近红外荧光为观测生理指标的最佳选择。
二. 生物发光与荧光发光对比
虽然荧光信号远远强于生物发光,但非特异性荧光产生的背景噪音使其信噪比远远低于生物发光。虽然许多公司采用不同的技术分离背景光,但是受到荧光特性的限制,很难完全消除背景噪音。这些背景噪音造成荧光成像的灵敏度较低。
目前大部分高水平的文章还是应用生物发光的方法来研究活体动物体内成像。但是,荧光成像有其方便,便宜,直观,标记靶点多样和易于被大多数研究人员接受的优点,在一些植物分子生物学研究和观察小分子体内代谢方面也得到应用。对于不同的研究,可根据两者的特点以及实验要求,选择合适的方法。最近许多文献报道的实验中,利用绿色荧光蛋白和萤光素酶对细胞或动物进行双重标记,用成熟的荧光成像技术进行体外检测,进行分子生物学和细胞生物学研究;然后利用生物发光技术进行动物体内检测,进行活体动物体内研究。
三. 生物发光系统(活体成像)选择
1. Firefly 萤光素酶/D-luciferin 系统
1) D-萤光素是最流行和多功能的生物发光底物。萤火虫萤光素酶/萤光素生物发光系统存在于萤火虫(Photinus pyralis)和其他几种甲虫中。萤火虫萤光素酶通过 D-萤光素的 ATP 依赖性氧化产生 560nm 生物光,并在数秒内达到峰值。当 D-萤光素和ATP 过量存在时,光输出与萤光素酶活性成正比。萤火虫萤光素酶与 HRP 和碱性磷酸酶相比,萤光素酶对化学修饰的耐受性较差,但该酶的一个显著优点是除了其高灵敏度之外,在哺乳动物细胞中具有低内源活性,信噪比高。
D-萤光素作为 Luciferase 的作用底物,常用于以下实验:In vivo imaging (动物活体成像);报告基因分析In vitro imaging (细胞体外分析);ATP 测定;其它 luciferase及其基因相关的分析和研究工作。
2) D-萤光素应用于活体成像的基本原理
细胞中 D-荧光素酶参与的化学发光反应遵守酶促反应的基本原理,在底物 D-荧光素钾过量的情况下,反应产生的光子数(发光量)与细胞中的 D-荧光素酶的量成正相关,从而可以推算出细胞的数量。
3) D-萤光素钾盐溶液的稳定性
D-萤光素钾盐易溶于水和缓冲液,溶解度可高达 25mg/mL。一般使用浓度为 3-15mg/mL。溶液的 pH 值、溶液中的氧气和保存时间对其保存过程中的稳定性非常重要。当溶液的 pH<6.5(发生水解作用)或>7.5(发生消旋化作用,D 型转化为 L 型)的情况下,D-萤光素钾盐相对不稳定。如果溶液中存在少量的氧气,将加速 D-萤光素钾的降解速度。
D-萤光素配成溶液后,在最佳的保存条件(-80°C,最佳 pH,无氧气)下,存在固定的降解速度:0.2%/天,因此配成溶液保存的 D-荧光素应尽量在 1 年内使用完。有水存在的情况下,主要发生消旋化作用,即 D-萤光素转化成 L-萤光素,有报道称 L-萤光素对萤光素酶催化的酶促反应有抑制作用。
4) D-萤光素、D-萤光素钠和 D-萤光素钾之间的区别
主要区别在于溶解和分散性能。D-萤光素钾盐在水和缓冲液中的溶解度高,且溶解速度较快,故在一般的生物学试验中常用 D-萤光素钾盐。
5) 其他注意事项
注意 1:如果溶液中存在少量的氧气,将加速 D-萤光素钾的降解速度。储备溶液
可以在不含 ATP 的水中制备,并在-20°C 下避光储存。必须用适当的碱中和游离酸溶
解。
注意 2:D-萤光素可与任何现有的文献或 ATP 分析系统一起使用。
注意 3:如果检测 ATP,请戴上手套并使用无 ATP 容器,尽量减少所有可能的ATP 污染源。仅使用无菌无 ATP 水和试剂。使用高压灭菌水进行所有试剂
2. Renilla 萤光素酶/ Coelenterazine 系统
天然腔肠素(Coelenterazine)是自然界中资源丰富的天然萤光素,是绝大多数海洋发光生物(超过 75%)的光能贮存分子。天然腔肠素可作为许多萤光素酶的底物,比如海肾萤光素酶(Rluc),Gaussia 分泌型萤光素酶(Gluc),以及水母发光蛋白(Aequorin)等。其发光原理是:以天然腔肠素为底物的萤光素酶在有分子氧的条件下,氧化腔肠素,产生高能量的中间产物,并在此过程中发射蓝色光,峰值发射波长约为 450~480nm。与萤火虫萤光素/萤光素酶系统不同,天然腔肠素/海肾萤光素酶系统不需要三磷酸腺苷(ATP),因此更便于体内生物发光的研究。因此,天然腔肠素常用作基于报告基因检测以及活体成像的发光底物。
天然腔肠素(Coelenterazine)是自然界中资源丰富的天然萤光素,是绝大多数海洋发光生物(超过 75%)的光能贮存分子。天然腔肠素可作为许多萤光素酶的底物,比如海肾萤光素酶(Rluc),Gaussia 分泌型萤光素酶(Gluc),以及水母发光蛋白(Aequorin)等。其发光原理是:以天然腔肠素为底物的萤光素酶在有分子氧的条件下,氧化腔肠素,产生高能量的中间产物,并在此过程中发射蓝色光,峰值发射波长约为 450~480nm。与萤火虫萤光素/萤光素酶系统不同,天然腔肠素/海肾萤光素酶系统不需要三磷酸腺苷(ATP),因此更便于体内生物发光的研究。因此,天然腔肠素常用作基于报告基因检测以及活体成像的发光底物。
此外,腔肠素还能在酶非依赖性的氧化体系中自发荧光,细胞和组织内的超氧阴离子和过氧化亚硝基阴离子能够增强该自发光信号,因此其也可用来检测细胞/组织内活性氧(ROS)水平。
3. NanoLuc 萤光素酶/Furimazine 系统
NanoLuc 萤光素酶是一个经过基因工程改造的小分子酶(19.1kDa),是性能卓越的生物发光报告基因。NanoLuc 萤光素酶在上市当年被 The Scientist 杂志评选为年度十大创新产品。它使用一种新型底物 furimazine,可产生高强度、辉光型发光。生物发光反应不依赖 ATP,自发光背景低,光信号更亮,同时抑制背景发光以获得最高检测灵敏度。
NanoLuc 萤光素酶具有许多使之成为出色报告基因蛋白的物理特性:
1) 分子量非常小,单体酶(171 个氨基酸;513bp);
2) 热稳定性高(Tm=60°C):室温下放置 8h,活性仍保留 90%;
3) 在很宽的的 pH 范围内有活性(pH 值 6-8);
4) 没有翻译后修饰或二硫键
5) 均匀分布在细胞中
6) 发射光谱非常适合于生物发光共振能量转移(BRET:λmax=465nm)
7) 辉光反应:室温半衰期通常>2h
NanoLuc 萤光素酶/Furimazine 生物发光系统出众特性,使得它应用更加广泛和灵活。
四. 生物发光试剂(活体成像)技术应用
通过活体动物体内成像系统,可以观测到疾病或癌症的发展进程以及药物治疗所产生的反应,并可用于病毒学研究、构建转基因动物模型、siRNA 研究、干细胞研究、蛋白质相互作用研究以及细胞体外检测等领域。
1. 标记细胞
1) 癌症与抗癌药物研究
直接快速地测量各种癌症模型中肿瘤的生长和转移,并可对癌症治疗中癌细胞的变化进行实时观测和评估。活体生物发光成像能够无创伤地定量检测小鼠整体的原位瘤、转移瘤及自发瘤。精诺真生物成像技术提高了检测的灵敏度,即使微小的转移灶也能被检测到(可以检测到体内 102 个细胞的微转移)。目前已商品化的肿瘤细胞株包括:前列腺癌,黑色素瘤,乳腺癌,肺癌,子宫颈癌和结肠癌等。
2) 免疫学与干细胞研究
将萤光素酶标记的造血干细胞移植入脾及骨髓,可用于实时观测活体动物体内干细胞造血过程的早期事件及动力学变化。
有研究表明,应用带有生物发光标记基因的小鼠淋巴细胞,检测放射及化学药物治疗的效果,寻找在肿瘤骨髓转移及抗肿瘤免疫治疗中复杂的细胞机制。应用可见光活体成像原理标记细胞,建立动物模型,可有效的针对同一组动物进行连续的观察,节约动物样品数,同时能更快捷地得到免疫系统中病原的转移途径及抗性蛋白表达的改变。
3) 细胞凋亡
当萤光素酶与抑制多肽以融合蛋白形式在哺乳动物细胞中表达,产生的融合蛋白无萤光素酶活性,细胞不能发光,而当细胞发生凋亡时,活化的 caspase-3 在特异识别位点切割去掉抑制蛋白,恢复萤光素酶活性,产生发光现象,由此可用于观察活体动物体内的细胞凋亡相关事件。
2. 标记病毒
1) 病毒侵染
以萤光素酶基因标记的 HSV-1 病毒为例,可观察到 HSV-1 病毒对肝脏、肺、脾及淋巴结的侵和病毒从血液系统进入神经系统的过程。多种病毒,腺病毒,腺相关病毒,慢病毒,乙肝病毒等,已被萤光素酶标记,用于观察病毒对机体的侵染过程。
2) 基因治疗
基因治疗包括在体内将一个或多个感兴趣的基因及其产物安全而有效的传递到靶细胞。可应用萤光素酶基因作为报告基因用于载体的构建,观察目的基因是否能够在试验动物体内持续高效和组织特异性表达。这种非侵入方式具有容易准备、低毒性及轻微免疫反应的优点。萤光素酶基因也可以插入脂质体包裹的 DNA 分子中, 用来观察脂质体为载体的 DNA 运输和基因治疗情况。
3. 标记细菌
1) 细菌侵染研究
可以用标记好的革兰氏阳性和阴性细菌侵染活体动物, 观测其在动物体内的繁殖部位、数量变化及对外界因素的反应。
2) 抗生素药物
利用标记好的细菌在动物体内对药物的反应,医药公司和研究机构可用这种成像技术进行药物筛选和临床前动物实验研究。近年来,国际上大型制药公司纷纷将精诺真技术在动物体内的实验结果作为 FDA(美国食品和药品检验局)药物申报材料中非常重要的临床前动物实验部分。
4. 转基因动物模型
1) 基因表达
为研究目的基因是在何时、何种刺激下表达,将萤光素酶基因插入目的基因启动子的下游,并稳定整合于实验动物染色体中,形成转基因动物模型。利用其表达产生的萤光素酶与底物作用产生生物发光,反应目的基因的表达情况,从而实现对目的基因的研究。可用于研究动物发育过程中特定基因的时空表达情况,观察药物诱导特定基因表达,以及其它生物学事件引起的相应基因表达或关闭。
2) 各种疾病模型
研究者根据研究目的,将靶基因、靶细胞、病毒及细菌进行萤光素酶标记,同时转入动物体内形成所需的疾病模型,包括肿瘤、免疫系统疾病、感染疾病等等。可提供靶基因在体内的实时表达和对候选药物的准确反应,还可以用来评估候选药物和其它化合物的毒性。为药物在疾病中的作用机制及效用提供研究方法。
